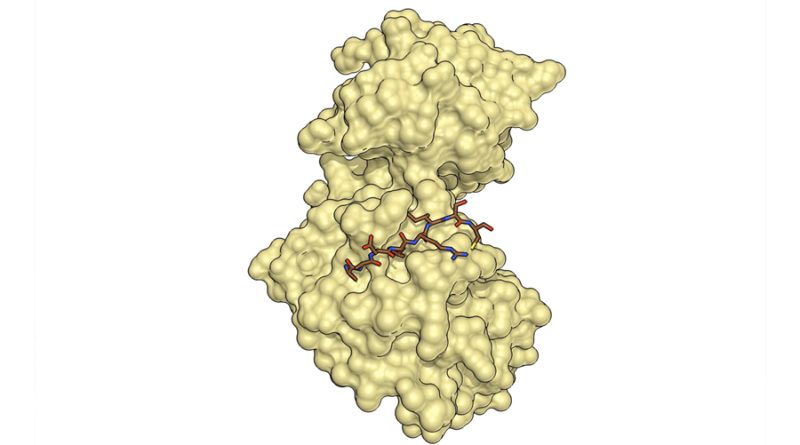
La proteína p38a, una enzima clave en la regulación de diferentes funciones celulares, desempeña un papel crucial en algunas enfermedades como el cáncer, la inflamación crónica o las enfermedades neurodegenerativas
Un equipo científico de investigadores ICREA del IRB Barcelona, ha descubierto que la proteína p38a adopta una conformación no descrita con anterioridad. Concretamente, los investigadores han descubierto una nueva forma “oxidada”, que la proteína adoptaría de manera transitoria según el estado redox de la célula, en la que se establece un puente disulfuro.
Esta nueva forma de p38a, que se ha descrito en la revista ‘Nature Communications’, no permite la unión con activadores ni con sustratos por lo que no es capaz de realizar las funciones características de esta quinasa. Se trata de un proceso reversible, y la función de la proteína se recupera en condiciones reductoras.
Desde su descubrimiento, diversas compañías farmacéuticas y numerosos grupos de investigación han dedicado esfuerzos considerables al desarrollo de moléculas destinadas a inhibir esta proteína, sin embargo, los resultados no han cumplido con las expectativas para poder desarrollar fármacos.
«La identificación de una nueva forma de p38a podría explicar las dificultades previas en el diseño de inhibidores efectivos de la p38a, ya que hasta ahora los estudios se habían centrado en las conformaciones reducidas. Nuestros resultados abren nuevas vías para el desarrollo de compuestos terapéuticos que modulen la actividad de p38a de forma más precisa», explica Maria Macias, investigadora ICREA.
Hasta ahora hay publicadas 357 estructuras de la proteína p38a, en la base de datos de Protein Data Bank, pero todas corresponden a su forma reducida, la única conocida hasta ahora. Esto se debe, posiblemente, a la prevalencia de condiciones experimentales que incluyen la presencia de agentes reductores en los estudios estructurales realizados.
“El estudio de quinasas en su forma oxidada resulta complejo debido a la influencia de condiciones de estrés oxidativo y la transitoriedad de estas formas en el entorno celular”, explican lss autores del trabajo. “Sin embargo, en ellas puede residir la clave para abordarlas de manera efectiva desde un punto de vista farmacológico”, concluyen.
Un enfoque prometedor
Esta nueva forma ilustra un mecanismo de acción de p38a regulado por el estado redox celular, explicando observaciones bioquímicas descritas hasta ahora pero sin base molecular estructural.
En futuros trabajos, los investigadores se centrarán en explorar nuevas cavidades de interacción que aparecen en la forma oxidada, ya que pueden ayudar a inactivar la proteína sin intervenir en el centro catalítico, ganando así especificidad.
Fuente: abc.es